Перекрестная резистентность.
Перекрестная резистентность к антибиотикам.
Основу невосприимчивости микроорганизмов к противомикробным препаратам составляют природная и приобретенная резистентность. Микроорганизмы, особенно бактерии, обладают множеством способов противодействия лекарствам. Природная устойчивость бактерий к определенным антибиотикам делает их неуязвимыми и приводит к неэффективности антибактериальной терапии.
Особый интерес представляет тот факт, что микроорганизмы могут быть устойчивы к антибактериальным препаратам, с которыми никогда не взаимодействовали. Исследования в этой области позволили систематизировать данные о некоторых видах бактерий (стафилококки, шигеллы, эшерихии, протей, Moraxella, Citrobacter, Acinetobacter, Providenciae), которые обладают устойчивостью не только к препаратам одной группы, но и к антибиотикам других групп.
Современные методы борьбы с антибиотикорезистентностью основаны на смене группы антибактериальных средств. Эти методы эффективны только в том случае, если бактерии не обладают перекрестной резистентностью к новому препарату. В ходе исследований были выявлены механизмы природной перекрестной резистентности бактерий к антибиотикам.
Например, перекрестная резистентность к антибиотикам, ингибирующим ферменты, синтезируемые бактериями (цефалоспориназы, пенициллиназы, карбапенемазы и другие бета-лактамазы), приводит к неэффективности синтетических пенициллинов и цефалоспоринов в отношении некоторых штаммов (например, стафилококка). В таких случаях назначают комбинации антибиотиков с ингибиторами этих ферментов (например, амоксициллин с клавулановой кислотой, ампициллин с сульбактамом), где ингибиторы помогают повысить эффективность лечения.
Похожую перекрестную резистентность проявляют бактерии к аминогликозидам (через синтез аминогликозидмодифицирующих ферментов), к фторхинолам (через модификацию ДНК-гиразы и топоизомеразы IV), к макролидным, линкозамидным и стрептограминовым антибиотикам (через модификацию рибосомы и синтез ферментов), к тетрациклинам (через модификацию рибосомы и активное выведение), а также к гликопептидам и сульфаниламидам (через модификацию мишени) и другим группам антибактериальных препаратов.
Перекрестная устойчивость у насекомых.
Перекрестная резистентность наблюдается не только у микроорганизмов, но и у насекомых.
Систематическая обработка 15-20 поколений клещей одним и тем же инсектицидом приводит к развитию устойчивости не только к этому инсектициду, но и к ядохимикатам других классов.
У насекомых перекрестная устойчивость к ядохимикатам формируется благодаря выработке ферментов, которые окисляют и выводят вредные метаболиты. Например, насекомые, выработавшие устойчивость к фосфорорганическим инсектицидам, также демонстрируют устойчивость к хлорорганическим инсектицидам. Устойчивость к пестицидам на основе карбаминовой кислоты приводит к устойчивости к фосфорорганическим соединениям. Поэтому рекомендуется чередовать инсектициды не только одного класса, но и разных химических классов, учитывая возможную перекрестную устойчивость.
Последствия
Пациентов с заболеваниями, вызванными резистентными микроорганизмами, часто лечат не одним антибиотиком, а их комбинациями. Курс лечения длится дольше обычного, что делает его затратным и выматывающим. Более того, доступность такого лечения не всегда гарантирована, что увеличивает смертность. Кроме того, под угрозу ставятся стандартные медицинские вмешательства, требующие антибиотиков, такие как полостные операции или химиотерапия.
Человек — это не только биологическое, но и социальное существо. Ему необходимо общение с другими людьми. Однако пациенты с инфекциями или ослабленным иммунитетом не могут полноценно взаимодействовать с окружающими из-за риска заражения. Например, отмена летних лагерей для детей с муковисцидозом была вызвана вспышками инфекций, вызванных резистентными штаммами. Другим ограничением является необходимость находиться в отдельных боксах в инфекционных больницах. Таким образом, антибиотикорезистентность негативно сказывается на психологическом состоянии и социализации людей.
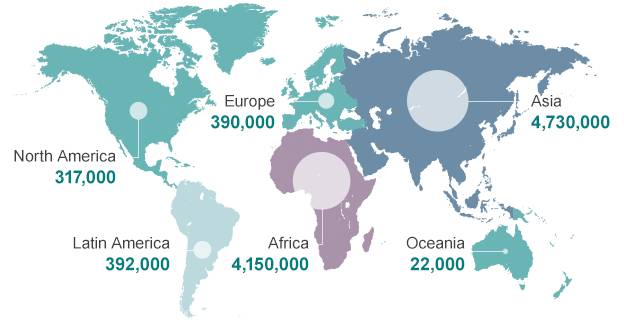
Группа под руководством британского финансиста Джима О’Нила подсчитала экономические потери, с которыми человечество столкнется к 2050 году, если не удастся решить проблему резистентности. По этому сценарию потери трудоспособного населения могут достичь 11–14 миллионов человек в год. В денежном выражении кумулятивные потери составят 100 трлн долларов, что означает средний годовой убыток в 3 трлн долларов. Для сравнения, годовой бюджет США превышает эту цифру всего на 0,7 трлн долларов.
Но настоящую цену резистентности подсчитать невозможно.
Диагностика
Правильную диагностику СЭВ может провести только специалист. Процесс включает три этапа:
- изучение истории болезни и опрос пациента;
- лабораторные исследования;
- тестирование.
Сначала врач изучает историю болезни, выясняет наличие хронических заболеваний и вредных привычек, а также уточняет симптомы, на которые жалуется пациент.
Для более полной картины назначаются лабораторные исследования, которые обычно включают:
- общий анализ крови;
- анализ на уровень гормонов;
- экспресс-тест на функции печени и почек.
Основным методом диагностики является тестирование, разработанное психологом В. В. Бойко. Тест состоит из 84 утверждений, на которые пациент отвечает “да” или “нет”. По результатам теста врач определяет фазу развития СЭВ, выделяя три фазы:
- Напряжение. Пациент остро переживает конфликтные ситуации, уровень тревожности повышается. Он недоволен собой и чувствует себя загнанным в угол. Психика борется.
- Резистенция. Пациент начинает реагировать на события неадекватно (кричит, плачет, срывается). Некоторые вещи перестают вызывать эмоции. Рабочие задачи остаются невыполненными, так как пациент не считает их важными. Психика начинает сдаваться.
- Истощение. В этой фазе у пациента возникает дефицит эмоций, отстраненность и нарушения со стороны психосоматики. Психика окончательно сдалась.
Если пациент не принимает меры, фазы сменяют друг друга.
Симптом «эмоционально-нравственной дезориентации».
Гены антибиотикорезистентности
Существуют два типа лекарственной резистентности: генетическая и негенетическая. Не генетическая резистентность наблюдается у бактерий с неактивным метаболизмом, которые не размножаются в обычных условиях. Эти бактерии могут развивать устойчивость к определённым антибиотикам, но эта способность не передаётся потомству, так как не основана на генетических изменениях.
Это характерно для патогенных микроорганизмов, вызывающих туберкулез. Человек может долго не подозревать о болезни, пока его иммунитет не ослабнет, что приводит к размножению микобактерий и прогрессированию заболевания. Однако для лечения туберкулеза используются те же препараты, так как бактериальное потомство остаётся чувствительным к ним.
Ситуация аналогична утрате белка в клеточной стенке микроорганизмов. Например, бактерии, чувствительные к пенициллину, могут терять клеточную стенку под воздействием антибиотиков пенициллинового ряда. Это делает их резистентными к пенициллинам и цефалоспоринам, так как у антибиотиков нет мишени для связывания. Однако это явление временное и не связано с мутацией генов. При восстановлении клеточной стенки антибиотикорезистентность исчезает.
Генетическая антибиотикорезистентность возникает из-за изменений на уровне генов. Мутации могут изменять структуру клеточной мембраны, вызывать выработку ферментов, защищающих бактерии от антибиотиков, и изменять свойства рецепторов бактериальной клетки.
Существуют два пути развития генетической резистентности: хромосомный и внехромосомный. Хромосомная резистентность возникает при мутации гена, отвечающего за чувствительность к антибиотикам. Такие мутации происходят редко и обычно вызваны действием лекарств. Они могут передаваться из поколения в поколение, формируя устойчивые штаммы бактерий.
Внехромосомная резистентность связана с плазмидами — генетическими элементами, находящимися вне хромосом. Плазмиды содержат гены, отвечающие за выработку ферментов и проницаемость клеточной стенки.
Антибиотикорезистентность часто возникает в результате горизонтального переноса генов, когда одни бактерии передают гены другим, не являющимся их потомками. Также могут наблюдаться случайные мутации в геноме патогена.
В 2015 году учёные из Китая описали ген MCR-1, обнаруженный в свином мясе и кишечнике свиней. Этот ген может передаваться другим организмам и вскоре был найден в других странах, включая США и Европу.
Гены антибиотикорезистентности могут стимулировать выработку новых ферментов. Например, фермент NDM-1, обнаруженный у бактерий Klebsiella pneumoniae в 2008 году, сначала был найден в Индии, а затем и в других странах.
Патогенные микроорганизмы могут проявлять устойчивость как к определённым антибиотикам, так и к различным группам препаратов. Перекрестная антибиотикорезистентность возникает, когда микроорганизмы становятся нечувствительными к препаратам с похожей химической структурой или механизмом действия.
Аномальная иммунологическая реакция
Одной из теорий серорезистентности сифилиса является морфогенез антиидиотипических антител, возникающих в ответ на образование противотрепонемных антител.
Этот тип резистентности характеризуется отсутствием возбудителя инфекции. Для более детального анализа системы можно обратиться к классическим иммунологическим реакциям.
Аллогенный антиген-возбудитель, попадая в организм, атакуется различными типами Т-лимфоцитов. Первые из них, «уничтожители», устраняют антиген, в то время как «помощники» анализируют его состав и передают результаты В-лимфоцитам, стимулируя их к выработке иммуноглобулинов типов A и M (ранние), а затем типа G (поздние).
После устранения аллогенных антигенов, благодаря иммунным свойствам или терапевтическому вмешательству, Т-лимфоциты-супрессоры завершают выработку антител, оставляя IgG на неопределённый срок. Эти антитела обеспечивают защиту организма при повторном контакте с антигенами-возбудителями. Некоторые инфекции вызывают постоянную выработку таких антител после перенесённых заболеваний, в то время как другие требуют временной выработки антител (от нескольких месяцев до нескольких лет).
Сифилис относится к инфекциям, которые не формируют приобретённый иммунитет. Под воздействием определённых факторов организм продолжает вырабатывать антитела, предотвращающие повторное заражение.
Существуют и другие виды аномальных иммунологических реакций. Т-лимфоциты-помощники, анализируя антиген, передают полученные данные своим «отпрыскам». Это явление называется иммунологической памятью: при повторном контакте с антигеном-возбудителем «помощникам» не требуется заново его анализировать, что позволяет В-лимфоцитам быстро начать выработку специфических антител.
Некоторые факторы могут заставить Т-лимфоциты-помощники неправильно идентифицировать новый антиген-возбудитель (воспринимая его как трепонему) и производить антитрепонемные антитела вместо необходимых специфических антител. Это объясняет сероколебания у пациентов, перенёсших сифилис, во время стрептококковой ангины или беременности, когда плод может выступать в роли антигена.
Резистентность к антибиотикам
Стремительный рост устойчивости бактерий к антибиотикам представляет серьезную угрозу для здоровья людей. По данным ВОЗ, вероятность смертельного исхода у пациентов с метициллино-резистентными штаммами стафилококка (MRSA) на 70% выше, чем у тех, кто инфицирован чувствительными к антибиотикам штаммами.
Во многих странах наблюдается рост резистентности E. Coli, основного возбудителя инфекций мочевыводящих путей, к фторхинолонам и цефалоспоринам. Все чаще фиксируются случаи устойчивости бактерий к резервным препаратам, таким как карбапенемы для Klebsiella pneumonia и 3-е поколение цефалоспоринов для гонореи. Заболевания, которые долгое время эффективно лечились антибиотиками, снова становятся опасными.
В некоторых случаях тест на чувствительность к антибиотикам показывает частичную или полную устойчивость к большинству традиционных препаратов для данной инфекции.
Эта ситуация связана с нерациональным и необоснованным применением противомикробных средств. Многие пациенты покупают лекарства не по назначению врача, а по рекомендациям друзей, фармацевтов, после просмотра рекламы или вспоминая, что когда-то этот препарат помог. У многих есть «любимые» лекарства, которые принимаются при первых признаках заболевания.
Важно понимать, что самоназначение антибиотиков, а также самостоятельная коррекция дозировок, кратности приема и длительности курса способствуют формированию и распространению устойчивых к антибиотикам бактерий.
Как развивается устойчивость к противомикробным препаратам?
Вторичная (приобретенная) резистентность к антибиотикам возникает из-за спонтанных мутаций в геноме микробной клетки после воздействия противомикробного средства.
Ключевой особенностью этих мутаций является их способность «запоминаться» бактериями и передаваться следующим поколениям патогенов, что способствует быстрому распространению устойчивых штаммов в окружающей среде.
Степень резистентности (сниженная чувствительность к антибиотикам или полная устойчивость) и скорость ее развития зависят от видов и штаммов бактерий.
Наиболее быстро под действием антибиотиков мутируют:
- стафилококки (грамположительные кокки);
- эшерихии (грамотрицательные бактерии);
- микоплазмы (внутриклеточные возбудители);
- протей (грамотрицательные бактерии);
- синегнойная палочка (грамотрицательные бактерии).
Антибиотикорезистентные стрептококки группы А, клостридии, сибироязвенные и гемофильные палочки встречаются значительно реже.
Среди механизмов формирования устойчивости наиболее важными считаются:
- ферментная инактивация антибиотика;
- модификация молекул-мишеней в микробной клетке;
- активное выведение антибиотика (эффлюкс);
- снижение проницаемости микробной мембраны для лекарства.
Поскольку активное выведение и нарушение проницаемости ограничивают доступ антибиотика в бактериальную клетку, их часто объединяют в один механизм резистентности.
Профилактика и восстановление
Очистить кровь от патогенных микроорганизмов, нормализовать микрофлору кишечника и повысить резистентность организма можно только комплексными мерами. Пробиотические добавки «Эвиталия» помогут избавиться от вирусной инфекции, очистить организм от шлаков и повысить сопротивляемость к инфекциям. Наилучший результат достигается при использовании клинически протестированных методов лечения. Патогенетическая терапия подавляет рост болезнетворных бактерий, блокируя процессы их деления и роста. Важным аспектом является повышение иммунитета и восстановление естественной микрофлоры кишечника, нарушенной вредными бактериями.
Современная медицина выделяет несколько методов профилактики инфекционных и вирусных заболеваний, которые передаются воздушно-капельным или контактным путем. Первостепенной задачей является изоляция больного. Полноценное питание, прогулки и физические упражнения на свежем воздухе способствуют повышению резистентности организма. Соблюдение норм личной гигиены также играет важную роль. Использование медикаментов, рекомендованных врачом, предотвращает дальнейшее инфицирование здоровых тканей.
Основные пути повышения резистентности организма:
— Активный и здоровый образ жизни.
— Полноценное питание с достаточным количеством овощей и фруктов.
— Оздоровительные процедуры закаливания.
Заболевания, вызванные патогенными микроорганизмами и вирусами, классифицируются на несколько групп: болезни желудочно-кишечного тракта, крови, дерматологические патологии и заболевания дыхательных органов.
Рассмотрим патологии желудочно-кишечного тракта. Основная причина заболеваний кишечника — нарушение микрофлоры под воздействием патогенных бактерий. Источниками этих микроорганизмов часто являются вода и продукты питания. Инфекции представляют опасность как для детей, так и для взрослых.
Парентеральную область и ЖКТ могут поражать бактериальные, грибные и вирусные инфекции, а также токсины, образующиеся в процессе их жизнедеятельности. Симптомы таких заболеваний включают периодические запоры, диарею, боли в области живота и другие признаки. Непереносимость легкоусвояемых сахаров и лактозы часто указывает на проблемы пищеварительного тракта. Натуральная биодобавка «Бифидум Эвиталия» содержит комплекс пробиотических микроорганизмов, которые быстро восстанавливают равновесие микрофлоры кишечника.
Диабет 1 типа и резистентность к инсулину
Инфракрасное излучение может влиять на диабет 1 типа, который называют «двойным диабетом».
Диагностика инсулинорезистентности (ИР) у пациентов с диабетом 1 типа затруднена из-за неспособности поджелудочной железы производить инсулин. Существует специальный эугликемический гиперинсулинемический клэмп-тест, который является надежным, но сложным, дорогим и трудоемким, поэтому его редко используют для диагностики ИР.
Индекс инсулинорезистентности
Метод включает одну внутривенную инфузию инсулина в дозе, достаточной для достижения гиперинсулинемии, и глюкозы, которая обеспечивает стабильные и нормальные уровни сахара в крови.
Чувствительность к инсулину оценивается по скорости инфузии глюкозы в последние 30 минут после достижения стабильного уровня глюкозы в крови. Весь тест занимает 2 часа.
Результат отражает поглощение глюкозы тканями и называется индексом распределения глюкозы (GDR).
Резистентность к инсулину что это такое
- Суммарная оценка ниже 4 мг/кг/мин может свидетельствовать о резистентности к инсулину.
- Более простым методом является наблюдение за дозой инсулина, необходимой для поддержания стабильного уровня сахара в крови.
- Если эта доза постоянно увеличивается, это может указывать на снижение чувствительности клеток к инсулину.
Причины резистентности к инсулину при диабете 1-го типа
Основной причиной инсулинорезистентности (ИР) у больных сахарным диабетом 1 типа являются гены бета-клеток поджелудочной железы и белок-переносчик глюкозы GLUT-4.
Аномальная транспортировка глюкозы в клетки, вызванная генетическим дефектом, может способствовать развитию ИР у таких пациентов.
Еще одной причиной является «глюкозная токсичность», которая связана с нарушением контроля уровня глюкозы у больных диабетом.
С увеличением индекса массы тела (ИМТ) наблюдается рост концентрации триглицеридов в сыворотке крови и снижение уровня HDL, что связано с повышенным спросом клеток на инсулин у пациентов с диабетом 1 типа.
Кроме того, подкожное введение инсулина, необходимое для поддержания нормального уровня глюкозы в крови, может приводить к периферической гиперинсулинемии.
Исследования на крысах, получавших высокие дозы инсулина, показали снижение чувствительности к его действию, что указывает на развитие инсулинорезистентности.
ИР диагностика и лечение сахарного диабета 1 типа
ИР у пациентов с сахарным диабетом 1 типа сложно диагностировать и лечить. Важно предотвращать его на ранних стадиях, поддерживая идеальную массу тела, занимаясь физической активностью и следя за сбалансированной диетой. Это поможет избежать необходимости в больших дозах инсулина для контроля уровня глюкозы в крови.
Факторы развития антибиотикорезистентности
Когда человек обращается к врачу с жалобами на здоровье, он ожидает квалифицированной помощи. При инфекциях дыхательных путей или других бактериальных заболеваниях задача врача — назначить эффективный антибиотик и определить нужную дозировку.
Выбор медикаментов у врача широкий, но как выбрать именно тот препарат, который поможет справиться с инфекцией? С одной стороны, для оправданного назначения противомикробного препарата необходимо выяснить тип возбудителя болезни. Это соответствует этиотропной концепции выбора препарата, которая считается наиболее правильной. С другой стороны, на это может уйти до трех дней, а своевременная терапия на ранних сроках болезни критически важна.
Врач, поставив диагноз, вынужден действовать в первые дни наугад, чтобы замедлить болезнь и предотвратить её распространение на другие органы (эмпирический подход). При амбулаторном лечении врач предполагает, что возбудителем могут быть определенные виды бактерий, что и определяет первоначальный выбор препарата. Назначение может изменяться в зависимости от результатов анализа на возбудителя.
Если назначение врача подтвердится результатами анализов, это хорошо. В противном случае теряется не только время. Для успешного лечения необходимо полное уничтожение патогенных микроорганизмов (иррадикация). Если этого не происходит, выжившие микробы могут выработать иммунитет к противомикробному препарату, что аналогично выработке антител в организме человека.
Таким образом, если антибиотик подобран неправильно или режим дозирования неэффективен, патогенные микроорганизмы могут не погибнуть, а измениться или приобрести новые свойства. Размножаясь, такие бактерии образуют популяции штаммов, устойчивых к антибиотикам, т.е. антибиотикорезистентных.
Еще одним фактором, негативно влияющим на эффективность антибактериальных препаратов, является использование антибиотиков в животноводстве и ветеринарии. Применение антибиотиков в этих областях не всегда оправдано, а определение возбудителя болезни часто не осуществляется или происходит с опозданием. Ветеринары действуют «вслепую», особенно когда речь идет о животных в тяжелом состоянии.
Ситуация усугубляется менталитетом, когда многие считают себя докторами. Развитие информационных технологий и возможность приобретать антибиотики без рецепта лишь усугубляют проблему. Неквалифицированные «доктора-самоучки» часто игнорируют рекомендации врачей, что приводит к серьезным последствиям.
В нашей стране многие люди остаются финансово несостоятельными и не могут позволить себе дорогие препараты нового поколения. Они заменяют назначения врача дешевыми старыми аналогами или средствами, рекомендованными знакомыми. Фраза «Мне помогло, и тебе поможет!» звучит убедительно, особенно если её произносит опытный человек. Однако мало кто задумывается, что патогенные микроорганизмы давно адаптировались к старым препаратам, и то, что помогло 50 лет назад, может оказаться неэффективным сегодня.
Реклама и желание попробовать новые препараты также способствуют самолечению. Многие задаются вопросом, зачем нужны врачи, если существуют «чудесные» препараты, о которых мы узнаем из СМИ. Однако проблема самолечения остается актуальной, и на неё стоит обращать внимание.
Пути преодоления антибиотикорезистентности
Как бы хорош ни был тот или иной препарат, нельзя исключать возможность изменения чувствительности патогенных микроорганизмов к нему. Создание новых препаратов с теми же действующими веществами не решает проблему антибиотикорезистентности. К новым поколениям препаратов чувствительность микроорганизмов также ослабевает при частых неоправданных или некорректных назначениях.
Прорывом стало изобретение комбинированных препаратов, известных как защищенные. Их применение оправдано для бактерий, вырабатывающих ферменты, разрушающие обычные антибиотики. Защита популярных антибиотиков осуществляется за счет добавления специальных средств, таких как ингибиторы ферментов, которые блокируют их выработку и предотвращают выведение препарата из клетки с помощью мембранного насоса.
В качестве ингибиторов бета-лактамаз используются клавулановая кислота или сульбактам. Их добавление к бета-лактамным антибиотикам повышает их эффективность.
В настоящее время разрабатываются препараты, способные воздействовать не только на отдельные бактерии, но и на их группы. Борьба с бактериями в биопленках возможна только после их разрушения и высвобождения микроорганизмов, ранее связанных химическими сигналами. Ученые рассматривают бактериофаги как перспективные средства для разрушения биопленок.
С другими бактериальными группировками борются, перемещая их в жидкую среду, где микроорганизмы начинают существовать раздельно, что позволяет использовать привычные препараты.